La chimie Minérale.
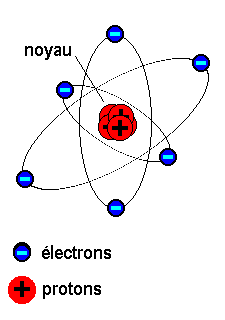
La matière à son niveau atomique est constituée d'un noyau atomique minuscule hyperlourd et dense qui par sa masse colossale ancre un nuage périphérique d'électrons hyperlégers et véloces. Le nuage électronique est chargé électriquement négativement à l'inverse du noyau central de l'atome chargé positivement. Cependant la charge électrique plus (+) du noyau atomique central est égale en intensité à la charge électrique moins (-) des électrons périphériques.
L'atome dans sa Globalité est électriquement neutre et le nuage électronique périphérique symétrique.
Les Atomes.
Atome. [Représentation Internet].
Le nuage d'électrons légers et véloces gravite en périphérie de l'atome.
Le noyau atomique lourd et "immobile" est fixé au centre de l'Atome.
Le noyau central se compose de lourds neutrons et de lourds protons agglomérés.
Le noyau dense par rapport au vide immobilise l'atome dans l'espace.
Le noyau atomique emprisonne les électrons ainsi captifs.
Dans son état fondamental l'Atome est neutre électriquement [le plus // le moins] du fait de la symétrie du nuage électronique.
Atome. [Représentation Internet].
L'atome est globalement neutre électriquement et relativement immobile dans l'espace.
Cliché Internet. La photographie symbolise les liaisons atomiques intérieures à l'atome. Celles-ci sont nouées entre le noyau atomique ancreur et les électrons agiles et hypermobiles en périphérie.
Ces liaisons sont de la taille du Fermi.
La chimie décrit les liaisons, les interactions nouées entre les atomes et les molécules de matière. La chimie minérale en particulier décrit les composés chimiques élémentaires dérivant d'associations simples d'atomes. La chimie organique s'en distingue par sa structure particulière articulée autour d'une longue chaîne d'atomes de carbone faisant office de colonne vertébrale à la molécule organique.
La liaison intra-atomique de la Taille du Fermi.
Le noyau atomique hypermassif et dense et "électriquement" positif, le plus (+) attire les électrons périphériques légers et "électriquement" négatifs, le moins (-). Ici les 2 pôles électriques de charges contraires mais d'intensité analogue s'attirent et se neutralisent. Satyre ?.. mais le plus et le moins ne s'épousent-t-ils pas ?
Derrière la neutralité électrique de l'atome se cache une symétrie fondamentale du nuage électronique; neutralité électrique résultant de sa forme géométrique fondamentale respectée par le contexte.
Les protons du noyau atomique (en rouge) de charge positive se lient étroitement aux électrons périphériques (en bleu) de charge négative.
Ici la liaison est intra-atomique et forte. Cette liaison est de la taille du Fermi.[Représentation Internet].
Charge électrique du proton = +1,602 10-19
Charge électrique de l'électron = -1,602 10-19
Charge électrique du neutron = 0
En valeur absolue les charges électriques positives et négatives sont équivalentes : |1,602 10-19|
Ainsi la répartition "symétrique" des charges positives et négatives décide de la géométrie intérieure de l'atome. Et celui-ci dans sa "Globalité" initiale est électriquement neutre. Ici l'atome affiche son état fondamental électriquement neutre et symétrique.
Le Dipôle temporaire atomique.
Parfois le nuage électronique de l'atome (les électrons en mouvement dans sa périphérie) se déforme temporairement sous l'impact du champ électrique externe E. Cette déformation génère une asymétrie du nuage électrique de l'atome qui crée alors un "dipôle électrique temporaire".
Un Dipôle permanent ou temporaire résulte d'une répartition asymétrique dans l'espace de la distribution des charges électriques. Le barycentre entre le plus (+) et le moins (-) ne se trouve plus au "milieu" des deux chagres mais décalé d'un côté ou de l'autre.
Ces dipôles naissent au sein de l'Atome ou au sein de la Molécule. Ils pôssèdent alors des tailles différentes. Poue le dipôle atomique ce sera la taille du Fermi.
Ce nuage atomique asymétrique est électriquement positif d'un côté et négatif de l'autre. Il résulte de cette asymétrie temporaire une orientation électrique temporaire et la perte de la neutralité électrique initiale de l'atome dans sa périphérie. Alors se forme un dipôle temporaire de la taille de l'atome.
 De cette asymétrie du nuage électronique de l'atome résulte un "dipôle électrique" temporaire sans variation d'énergie.
De cette asymétrie du nuage électronique de l'atome résulte un "dipôle électrique" temporaire sans variation d'énergie.
Ce dipôle atomique temporaire oscille autour de son point barycentre et alors émet une onde à énergie constante. Cette onde en propagation concentrique possède une longueur d'onde Lambdainvariante.
Reste que de l'attraction et de la répulsion liée aux charges électriques positive ou négative résulte une liaison atomique de la Taille du Fermi; c'est-à-dire d'une dimension très, mais alors très petite; celle de la taille de l'atome. _ Une liaison atomique de la taille d'une fourmi ! c'est bien trop petit ça ! Voyons Clopî, la liaison atomique est d'une taille encore bien plus petite que celle d'une fourmi.
La masse du noyau atomique énorme relativement à celle des électrons périphériques légers "attire" les électrons par la force de gravitation. Ainsi deux forces distinctes se conjuguent dans l'atome de la taille du Fermi, la force de gravitation centripète et constamment orientée vers le noyau atomique et la force électrostatique (électrique) aux orientations variables; centrifuge ou centripète.
Exemple; l'atome d'Oxygène.

Atome d'Oxygène. [Repésentation Internet. Produits de Santé Aqua].
Le noyau de l'atome d'oxygène se compose de 8 neutrons et de 8 protons assemblés formant un lourd, immobile et dense noyau de matière. Ce noyau fortement positif électriquement emprisonne dans sa périphérie 8 électrons légers, éthérés et véloces. Ces électrons gravitent autour du noyau capturés par la force centripète gravitationnelle. Spontanément ces électrons gravitent en symétrie si le contexte électromagnétique est neutre.
Une bite d'amarrage fait office équivalent au noyau atomique hypermassif et très positif en électricité. Il capture les électrons et les maintient le plus possible dans sa périphérie; c'est sa raison d'être.
La liaison intra-moléculaire d'une taille supérieure.
Allez on passe à la taille au-dessus du Fermi. Ainsi les atomes se lient entre-eux par des liaisons chimiques inter-atomique; des liaisons établies entre les atomes pour former les molécules; des assemblages plus ou moins complexes d'atomes.
Aussi les atomes mettent en commun les électrons de la couche périphérique si cela est possible afin de former des liaisons covalentes électroniques.
Les Liaisons covalentes.
L'assemblage d'atomes par le biais des doublets d'électrons périphériques partagés construisent les Molécules. Ainsi les liaisons chimiques s'établissent par la "mise en commun" d'une partie ou de tous les électrons de la couche périphérique du nuage électronique.
Ce partage d'électrons périphériques se réalise selon une "cohérence électrique" rigoureuse.
Cependant une conséquence majeure; la liaison électronique covalente impose un changement d'échelle de l'ecture ou d'analyse; et bien sûr de fonctionnement. Ainsi passe-t-on d'un univers infra-atomique, un univers de la taille de l'atome à un univers extra-atomique de la taille des molécules. Ainsi l'on change de taille de la structure de la matière; on change de fonctionnalité de la matière et l'on change au final de niveau de complexité.

La liaison électronique.
Les liaisons covalentes sont symétriques ou asymétriques géométriquement et électriquement. Le doublet d'électron est équitablement réparti entre les deux atomes ou pas.
Cependant parfois... un noyau atomique tire élégament la couverture du (ou des) doublet(s) à soi... ce qui entraine la création d'un dipôle électrique temporaire ou permanent.
La Chimie minérale décrit les combinaisons "simples" d'atomes. Aussi ne sont pas présentes les longues chaines d'atomes de Carbone structurant le squelette des grandes molécules dites "organiques"; les molécules intervenant dans la construction du "vivant".
Les liaisons électroniques sont plus ou moins intenses et plus ou moins résistantes à la rupture selon leurs qualités intrinsèques. Par ailleurs elles utilisent selon leur nature plus ou moins d'énergie. De la nature des liaisons chimiques résulte la forme "induite" et la géométrie des molécules et leurs propriétés spécifiques qui en découlent. Ainsi une plus ou moins grande rigidité, une plus ou moins grande fragilité; ou une polarité plus ou moins intense, une orientation spatiale plus ou moins affirmée, une dynamique plus ou moins intense...
Ainsi la géométrie et le comportement et les propriétés des molécules dépendent de ce jeu d'assemblages d'électrons mobiles et de nuages périphériques déformables plus ou moins électrisés... de la taille du FERMI.
Et ainsi vogue la galère.
LUCY d'Enfer. Le 23 Janvier 2017. Et LUCY se fit un brin asymétrique; elle s'est ionisée.
 Albert JACQUARD. La science à l’usage des non-scientifiques. Calmann-lévy.
Albert JACQUARD. La science à l’usage des non-scientifiques. Calmann-lévy.
Mensuel La Recherche. L'Inflation est remise en cause. N° 528. Octobre 2017.
L. BENACCHIO. P.BENEDETTI. M. RASOTTO. C. VENTURINI. Origines… du néant à la vie. GEO. Flammarion. Le Trésor. Michel SERRES et Nayla FAROUKI. Le Trésor. Dictionnaire des Sciences. Flammarion.
Joel LEVY. Petit précis de chimie à déguster en familles. Edition BELIN.













/https%3A%2F%2Fstorage.canalblog.com%2F86%2F92%2F1504840%2F130586501_o.png)
/https%3A%2F%2Fstorage.canalblog.com%2F29%2F08%2F1504840%2F128734339_o.jpg)
/https%3A%2F%2Fstorage.canalblog.com%2F52%2F07%2F1504840%2F130422217_o.jpg)
/https%3A%2F%2Fstorage.canalblog.com%2F60%2F68%2F1504840%2F130181210_o.png)


/https%3A%2F%2Fprofilepics.canalblog.com%2Fprofilepics%2F1%2F5%2F1538622.jpg)
/https%3A%2F%2Fstorage.canalblog.com%2F66%2F61%2F1504840%2F127026518_o.jpg)
/https%3A%2F%2Fstorage.canalblog.com%2F88%2F07%2F1504840%2F125523981_o.jpg)
/https%3A%2F%2Fstorage.canalblog.com%2F64%2F02%2F1504840%2F125430200_o.jpg)